W niedawnym badaniu opublikowanym w czasopiśmie, Biologia komórki naturyW tym badaniu naukowcy wykazali podatność gruczołów ślinowych na koronawirusa-2 zespołu ostrej niewydolności oddechowej (SARS-CoV-2). w laboratorium Wykorzystanie modelu hodowli organoidów.
 Stado: Zakażenie i nawrót zakażenia gruczołu ślinowego wywołanego przez ludzkie komórki macierzyste. Źródło obrazu: NIAID
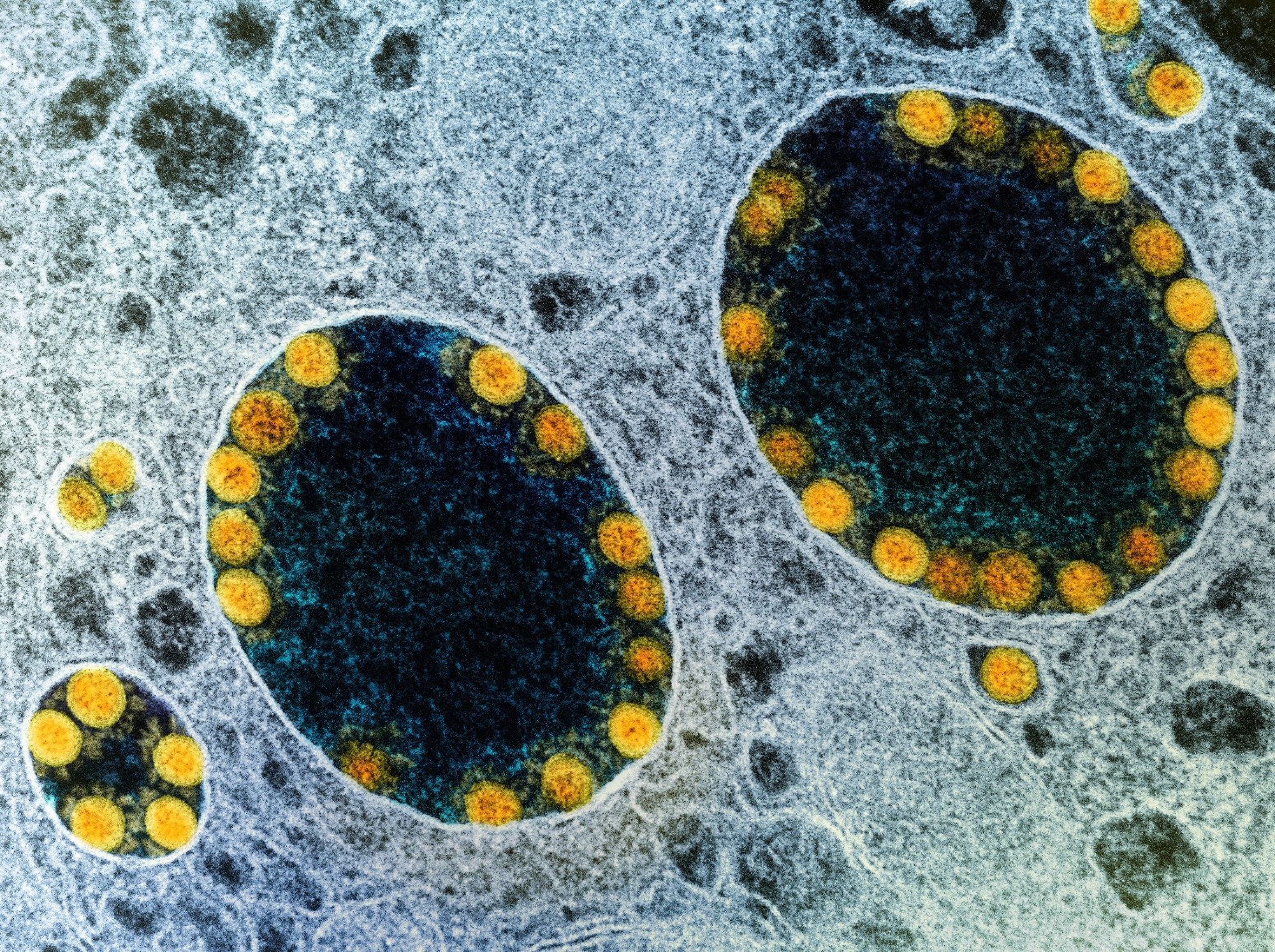
Stado: Zakażenie i nawrót zakażenia gruczołu ślinowego wywołanego przez ludzkie komórki macierzyste. Źródło obrazu: NIAID
tło
Chociaż drogi oddechowe, w tym górne drogi oddechowe (URT) i płuca, są głównymi miejscami docelowymi SARS-CoV-2, istnieje coraz więcej dowodów na to, że atakuje on wiele narządów. Na przykład błona śluzowa jamy ustnej i gruczoły ślinowe eksprymują dwa czynniki wejścia dla SARS-CoV-2, enzym konwertujący angiotensynę 2 (ACE2) i proteazę transbłonową 2 (TMPRSS2). Służą również jako zbiorniki dla SARS-CoV-2.
Co ciekawe, 80% zakażeń SARS-CoV-2 przebiega bezobjawowo. Ponadto badania wykazały, że SARS-CoV-2 atakuje gruczoły ślinowe u ludzi, a zakaźne wirusy ze śliny osób bezobjawowych przyczyniają się do dalszego przenoszenia wirusa.
Ze względu na zdolność SARS-CoV-2 do infekowania wielu rodzajów organelli, model hodowli organelli może być odpowiedni do ustalenia zakażenia SARS-CoV-2 w gruczołach ślinowych (w laboratorium). Jednak z braku okazji w laboratorium modele, badania nie były w stanie wyjaśnić mechanizmów leżących u podstaw infekcji SARS-CoV-2 i nawrotów w gruczołach ślinowych i późniejszego wydzielania w ślinie.
o nauce
W tym badaniu naukowcy wytworzyli funkcjonalne organoidy z ludzkich gruczołów ślinowych Zawiera pluripotencjalne komórki macierzyste (hiPSC) o podobnych cechach morfologicznych i funkcjach fizjologicznych (in vivo) jako ludzkie gruczoły ślinowe. Ponadto te organelle miały linie komórkowe specyficzne dla gruczołów ślinowych.
Zespół przeprowadził sekwencjonowanie pojedynczych komórek RNA (scRNA-seq) komórek hiSG w dniu 80 przy użyciu platformy 10X Genomics. Ponadto wyizolowali organelle w dniu 60 i hodowali je z czynnikiem wzrostu fibroblastów (FGF) 7 i 10 do dnia 80 w celu zróżnicowania obserwowanych struktur rozgałęzień.
Gen czynnika transkrypcyjnego SRY box 9 (SOX9) reguluje rozwój gruczołów ślinowych zarówno szczurów, jak i ludzi. W przypadku jego braku gruczoły ślinowe nie mogą się rozgałęziać. Dlatego naukowcy tłumili SOX9 podczas indukcji hiSG, aby wyjaśnić, czy hiSG rekapitulują proces wzrostu, w którym pośredniczy SOX9.
Wyniki
Indukowane przez człowieka gruczoły ślinowe (hiSG) mają właściwości podobne do właściwości gruczołów ślinowych płodu, w tym ekspresję morfologiczną, ekspresję markerów białkowych i właściwości ekspresji genów. zgodnie z in vivo W badaniach na myszach knockdown SOX9 hamował tworzenie gałęzi w hiPSC, co wskazuje, że gen ten jest niezbędny dla rozwoju ludzkiego gruczołu ślinowego. Tak więc ten model badawczy może zastąpić modele zwierzęce wykorzystywane do badania rozwoju ludzkich gruczołów ślinowych.
hiSGs morfologicznie i funkcjonalnie naśladują prawidłowe gruczoły ślinowe. Bezstronne zestawy scRNA-seq zidentyfikowały sześć głównych grup komórek, które można podzielić na podtypy komórkowe. Mała grupa mezenchymów w HiSG nie wykazywała cech mezenchymalnych ślinianek. Odwrotnie, grupa komórek nabłonkowych zawierała pięć grup komórek, komórki groniaste, komórki podstawne, przewód, komórki mioepitelialne i aktywne komórki krążące. hSG obejmowały niezależne linie komórek podstawnych nabłonka z linii przewodowej i groniastej, a analiza pseudo-czasowa wykazała różnice w tych dwóch liniach komórkowych.
Podstawową funkcją gruczołów ślinowych jest wydzielanie płynu indukowanego przez acetylocholinę poprzez szlaki muskarynowego receptora acetylocholiny. W przypadku hSG leczenie karbacholem, agonistą muskarynowego receptora acetylocholiny, powodowało przejściowy wzrost wewnątrzkomórkowego poziomu wapnia w sposób zależny od dawki. Co więcej, ortotopowo wszczepione hiSG prezentowały z czasem fenotyp dojrzałych gruczołów ślinowych wszczepianych myszom w miejsce biorcze.
Analizy scRNA-seq i immunofluorescencji również wykazały, że komórki przewodowe w obrębie hSG obficie eksprymowały ACE2 i TMPRSS2, podobnie jak normalne gruczoły ślinowe. Metoda immunoprecypitacji wykazała, że podczas gdy komórki przewodowe wierzchołkowe boczne hSG silnie wyrażają ACE2, komórki przewodowe i komórki groniaste wyrażają TMPRSS2. Po ekspozycji na SARS-CoV-2, hiSG zostały zakażone i wykazywały replikację SARS-CoV-2 w ciągu 24 godzin po zakażeniu. Autorzy wykryli również białko jądrowe SARS-CoV-2 w zakażonych komórkach przewodowych. W związku z tym mediana dawki zakaźnej dla hodowli tkankowej (TCID50) Test wykazał obecność zakaźnych wirusów w hSG, która osiągnęła szczyt po 24 godzinach, ale następnie uległa zmniejszeniu.
Wnioski
Rzeczywiście, hiSG opracowane w ramach obecnych badań mogą służyć jako cenny model reprodukcji heterogenicznych populacji komórek w ludzkich gruczołach ślinowych. Co więcej, hiSG mogą pomóc w funkcjonalnej analizie genów podczas rozwoju i służyć jako obiecujące narzędzie do badania infekcji SARS-CoV-2 w gruczołach ślinowych na poziomie molekularnym. Ponadto naukowcy wykazali, że hiSG mają kilka zalet w porównaniu z organellami pochodzącymi z komórek macierzystych tkanek pochodzących z gruczołów ślinowych dorosłego człowieka. Na przykład, można je łatwo modyfikować genetycznie za pomocą zestawu naprzemiennych krótkich i oddalonych od siebie (CRISPR)-CRISPR-skojarzonych powtórzeń białka 9 (Cas9) i były stosunkowo łatwe w hodowli.





More Stories
Nowy raport WHO pokazuje, jak miasta przyczyniają się do postępu w zapobieganiu chorobom niezakaźnym i urazom
Naukowcy identyfikują „najlepszy punkt” bezpiecznej operacji po zawale serca
Badanie wykazało, że 20% dzieci chorych na zapalenie płuc nie otrzymuje antybiotyków