W tym badaniu wykorzystaliśmy ES, testy panelowe genów i testy pojedynczego wariantu, aby osiągnąć 100% skuteczność diagnostyczną u pacjentów z OI. Dane demograficzne pacjentów są reprezentatywne dla Przylądka Zachodniego, przy czym szpital Tygerberg jest największym ośrodkiem referencyjnym trzeciego stopnia w prowincji. Ponieważ jest to część kliniki pediatrycznej, większość pacjentów ma mniej niż 18 lat.
Jak wspomniano wcześniej, badania sugerują, że warianty patogenne w COL1A1 Lub COL1A2 Geny odpowiadają za około 90% przypadków OI [5]. Zostało to potwierdzone w tym badaniu, w którym zauważono, że u około 94% pacjentów w tej grupie prawdopodobny wariant przyczynowy COL1A1 Lub COL1A2Co dowodzi, że warianty tych genów leżą u podstaw większości OI w naszej populacji.
Kilku godnych uwagi pacjentów w tym badaniu to pacjenci z YMUQ i KTWW. Na podstawie zidentyfikowanych wariantów oczekiwano, że pacjenci SWFC i YMUQ będą mieli fenotyp śmiertelny, ponieważ obaj mają COL1A1 Podstawienia Gly-Val w kierunku C-końca reszty 200, które prawie zawsze są śmiertelne [11]. Jednakże YMUQ przeżył poważne wady rozwojowe, podczas gdy SWFC uległ tej chorobie w wieku 2 lat. Pacjentka KTWW również przeżyła, ale z poważnymi wadami rozwojowymi, zgodnymi z grupą śmiertelną w szeregu α2(I), gdzie znajduje się jej wariant. [11]. Należy zauważyć, że fenotypy mniejszych reszt łańcucha bocznego, takich jak seryna, są bardziej zróżnicowane i mogą wpływać na profil stabilności potrójnej helisy. Ta zmienność znajduje odzwierciedlenie w nasileniu OI typu II u pacjentów takich jak KTWW. Wspiera to badania pokazujące, że każda seria ma swój własny związek genotyp-fenotyp, potwierdzając ideę regionalnego modelu patofizjologii OI. Zmienność fenotypowa OI może być spowodowana dotkniętym genem łańcucha kolagenowego, rodzajem i lokalizacją wariantu, naturą chemiczną podstawionego aminokwasu lub ich kombinacją. [11, 12].
wspólna alternatywa (COL1A2:c.1892G>T) zidentyfikowany 27 (N = 1 ES (dugr) f N = 26 paneli genowych) pacjenci są przykładem nieśmiercionośnej substytucji waliny COL1A2(p.Gly631Val) (Tabela 1). Stwierdzono, że podstawienia Gly-Val w α2(1) są bardziej zróżnicowane niż w α1(I), co wyjaśnia łagodniejszy fenotyp tych pacjentów. [11]. Sugerujemy, że jest to pierwsze doniesienie o tym wariancie w populacji afrykańskiej. Wszyscy pacjenci i ich rodziny mają mieszane pochodzenie południowoafrykańskie i potrzebne są dalsze badania, aby ustalić, czy mają wspólny haplotyp.
Chociaż są mniej powszechne, geny niekolagenowe mogą mieć warianty powodujące OI, co zaobserwowano u 3 pacjentów (PXYU, P13 i P14). Stwierdzono, że pacjent PXYU ma heterozygotyczny wariant patogenetyczny w… IFITM5 (c.-14C>T; ClinVar VCV000037143.35) i zdiagnozowano u niego klinicznie postępujący, zniekształcający typ OI (ryc. 2). Na podstawie wcześniejszych badań wykazano, że wariant ten jest patogenny i prowadzi do typu V OI (OMIM 610967) w 5–10% wszystkich przypadków OI. [13]. Objawy kliniczne często kojarzone z typem V OI obejmują tendencję do tworzenia modzeli hiperplastycznych po złamaniach, zwapnienie błony międzykostnej przedramienia i linię przynasadową kości długich o dużej gęstości promieniotwórczej. [14]. Co ciekawe, u tego pacjenta nie wykazano żadnych typowych cech radiologicznych OI typu V na zwykłym zdjęciu rentgenowskim. Miała już 5 lat, doznała kilku złamań i poruszała się na wózku inwalidzkim. Wysoka zmienność fenotypowa jest powszechna u osób z OI typu V, jak wykazano u tego pacjenta, prawdopodobnie z powodu zmienionych genów. [15].
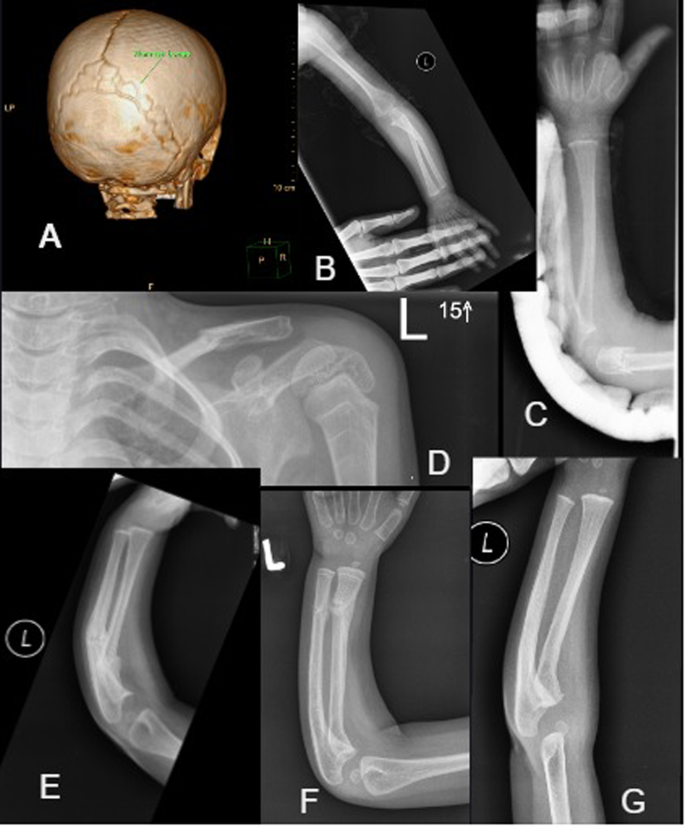
A CT czaszki (wiek 2,5 roku): widoczne liczne kości klinowe. B Złamanie lewej kości łokciowej (środkowego trzonu) w wieku 13 miesięcy – brak widocznych zrogowaceń. C Złamanie dalszej części kości łokciowej i promieniowej w 23 miesiącu życia. dr Złamanie lewego obojczyka w wieku 4 lat (zwróć uwagę na linie zebry na bliższej części kości ramiennej po leczeniu bisfosfonianami). H Złamanie środkowej części kręgosłupa kości łokciowej i promieniowej w 14 miesiącu życia z łagodnym utworzeniem kalusa. F & G Złamanie bliższej kości łokciowej/promieniowej zagoiło się po 19 miesiącach.
Stwierdzono, że pacjenci w wieku od 13 do 14 lat są homozygotami FKBP10Wiadomo, że wariant (c.831dup), powszechny w Republice Południowej Afryki, powoduje postępujące zniekształcenie OI. Oboje mieli liczne złamania w okresie niemowlęcym i dziecięcym, dentinogenesis imperfecta i szarą twardówkę. Pacjent 13 jest bardziej dotknięty, ma poważne deformacje i porusza się na wózku inwalidzkim (ryc. 3). Jest jedyną osobą w rodzinie dotkniętą tą chorobą. Pacjent 14 przeszedł wiele interwencji ortopedycznych i jest uruchamiany za pomocą urządzeń wspomagających (ryc. 4). Znacząco częste występowanie tego wariantu w populacji Republiki Południowej Afryki sugeruje, że jest on wynikiem wspólnego efektu założyciela przodków w rdzennej grupie populacji czarnej Afryki. [8]. Ponieważ pacjent 14 miał typowe OI związane z FKBP10, zdecydowaliśmy się najpierw przetestować powszechny wariant. Test ten jest dostępny za pośrednictwem naszego Krajowego Laboratorium Zdrowia i często jest testem pierwszego rzutu u czarnoskórych pacjentów z Republiki Południowej Afryki z postępującymi nieprawidłowościami w OI. Co ciekawe, w tym badaniu wariant ten zidentyfikowano po raz pierwszy u pacjenta o mieszanym pochodzeniu południowoafrykańskim (pacjent 13), co stanowi uzupełnienie tego, co wcześniej wiedzieliśmy o tym konkretnym wariancie w naszej populacji. Jedną z konsekwencji tego może być włączenie do testowania tego wariantu większej liczby pacjentów, a nie tylko pacjentów rasy czarnej z Afryki, jak jest to obecnie praktykowane.
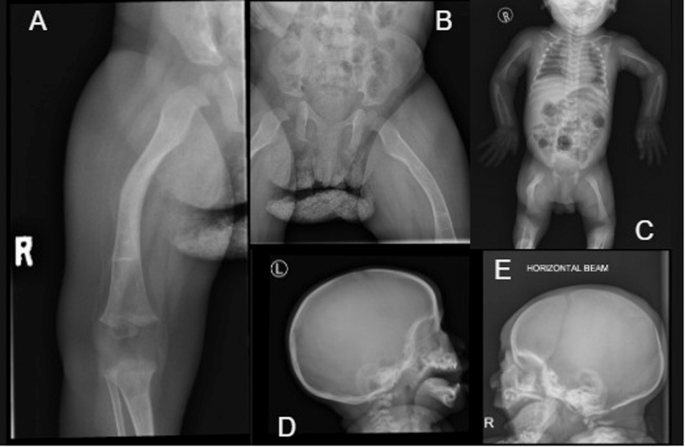
A Deformacja prawej kości udowej z osteoporozą i rozrostem przynasadowym stawu kolanowego w wieku 13 miesięcy. B Deformacja prawej kości udowej i osteopenia pojawiają się w 11 miesiącu życia. C Babygram w wieku 9 dni pokazuje uogólnioną osteoporozę i kątową prawą kość udową. dr Boczna czaszka w wieku 11 miesięcy z widocznymi kośćmi klinowymi. H Boczna czaszka po 9 dniach z widocznymi kośćmi ciepłymi i wyraźnymi szwami czołowymi.
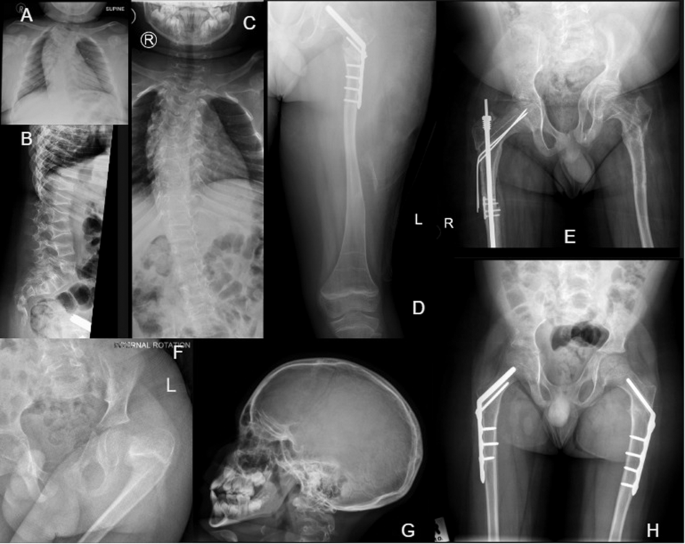
A Klatka piersiowa AP wykazująca skoliozę w wieku 9 lat. B Boczny kręgosłup ze złamaniami klinowymi kręgów lędźwiowych w wieku 9 lat. C AP klatki piersiowej wykazuje skoliozę i nieprawidłowe kręgi w wieku 10 lat. dr Lewa noga wykazuje łagodną deformację, cienkie kolumny kości udowej, paski zebry po leczeniu bisfosfonianami i gwoździe kostne głowy kości udowej w wieku 12 lat. H AP i bliższa kość udowa wykazują asymetryczną miednicę, cienkie kolumny kości udowej oraz osteopenię i pręty prawej kości udowej w wieku 13 lat. F Złamanie i deformacja głowy lewej kości udowej w wieku 5 lat. G Boczna czaszka z widocznymi licznymi kręgami w wieku 9 lat. H Miednica AP i bliższa część kości udowej ze śrubami kostnymi i płytkami korekcyjnymi w wieku 7 lat.
Wariant patogenny w BRCA1 (c.181T>G), o którym wiadomo, że powoduje dziedziczną predyspozycję do raka piersi i jajnika (OMIM 604370) stwierdzono u pacjentki KTWW. Jak dotąd tylko dwóch innych członków rodziny zgłosiło się po poradę genetyczną i badania. Obydwoje zostali zarejestrowani w odpowiednich programach nadzoru nad nowotworami. Wariant patogenny w PTBN11(c.1492C>T), o którym wiadomo, że jest związany z zespołem Noonana (OMIM 601321), zidentyfikowano u pacjenta MXHC. Odwrotny fenotyp ujawnił, że pacjent miał pewne cechy zgodne z zespołem Noonana. Dlatego ma podwójną diagnozę. chwila PTBN11Genetyk medyczny, który nie należy do 73 genów możliwych do wykorzystania, zdecydował się zgłosić ten wariant rodzinie, ponieważ ma on ważne implikacje kliniczne i reprodukcyjne.

„Odkrywca. Entuzjasta muzyki. Fan kawy. Specjalista od sieci. Miłośnik zombie.”






More Stories
Bardziej ekologiczne wybory, bystrzejsze umysły: badania łączą zrównoważony rozwój i zdrowie mózgu
Coraz częstsza liczba chorób przenoszonych przez komary w Europie – jak bardzo martwią się naukowcy? | Transmisja
Badanie asocjacji całego genomu pozwala zidentyfikować genetyczne czynniki ryzyka demencji